
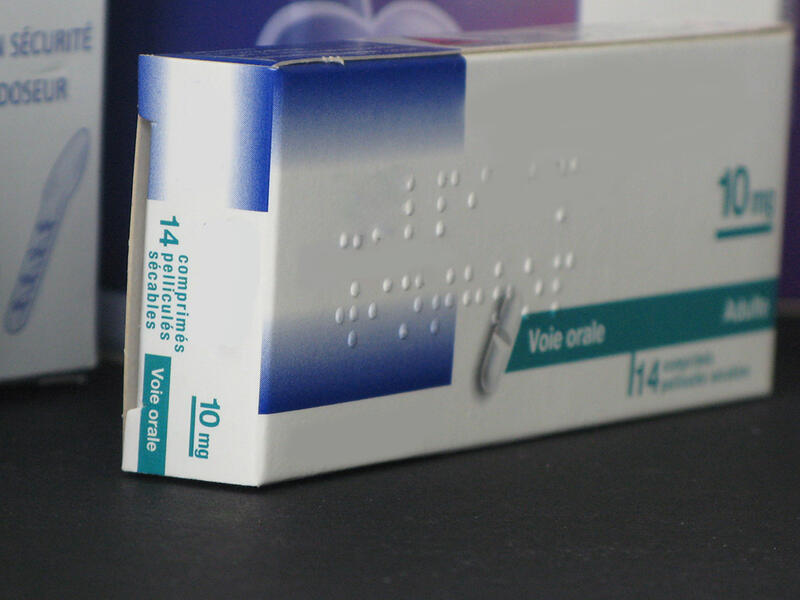
Contrôle du marquage Braille
Mesure de la hauteur des points de Braille
- Mesure de la hauteur des points de Braille par méthode optique sans contact
- Contrôle qualité pour les transformateurs d’étuis et pour l’industrie pharmaceutique
- Essais selon la norme NF EN ISO 17351 Emballage - Braille sur les emballages destinés aux médicaments
Informations générales
La Directive Européenne 2004/27/CE a rendu obligatoire l’inscription en Braille du nom et du dosage du médicament sur les étuis pharmaceutiques à l’usage du public, pour toute nouvelle autorisation de mise sur le marché depuis le 30 Octobre 2005.
Cette directive a été renforcée par la norme ISO 17351 qui impose des contrôles de la hauteur des points, avec l’objectif de garantir aux utilisateurs non-voyants l’assurance de la lisibilité des inscriptions en Braille.
La nécessité d’assurer et de contrôler la qualité du marquage Braille concerne en premier lieu les producteurs d’étuis en carton plat pour emballage pharmaceutique ainsi que l’ensemble des acteurs de la filière de l’emballage pharmaceutique. Cependant, l’inscription en Braille est également en place dans d’autres secteurs tels que la parapharmacie, la cosmétique et l’agro-alimentaire.
Données Techniques et Réalisations
Conformité à la norme NF EN 15823 « Braille sur les emballages destinés aux médicaments »
- Détermination de la hauteur des points de Braille, par méthode optique sans contact basée sur la triangulation laser.
- Les données suivantes seront délivrées : hauteur de chaque point, moyenne et écart-type de la distribution de hauteur par étui, nombre de points de hauteur inférieur à 0.1 mm, nombre de points de hauteur inférieure à 0.12 mm.
- Une image 3D des points de Braille peut également être fournie.
 |
 |
|